Mais alors on peut se poser les questions suivantes:
-Pourquoi n'y a -t-il pas de bulles dans la bouteille de champagne fermée?
-Comment le dégagement gazeux va -t-il se présenter?Se traduira-t-il seulement par un dégagement gazeux?
Dans le champagne comme dans les autres vins pétillants ou dans les bières...les bulles résultent de la désorption progressive du dioxyde de carbone,c'est à dire son passage de l'état dissous à l'état gazeux,mais ce dès
que le bouchon est retiré!
Pourquoi n'y-a-t-il pas de bulles dans la bouteille fermée?
Nous avons vu que la prise de mousse
s'effectue dans l'espace fermée de la bouteille , la quantité de dioxyde de carbone dans une bouteille ne peut s'échapper et rappelons le c'est pour cela que la
pression interne de la bouteille augmente!
La solubilité
est une notion qui s'applique aussi pour les gaz ainsi ici le CO2 sera dissous dans le champagne jusqu'à un certain stade mais une fois dépassé il voudra s'échapper.On comprend donc que la solubilité d'un soluté dépend de celui-ci mais
la solubilité en particulier d'un gaz dépend d'un autre paramètre: la pression.
C'est la loi de Henry
qui explicite cela en affirmant que la solubilité maximale d'un gaz ou encore comme nous venons de le voir sa concentration maximale dans le solvant est proportionnelle à la pression qu'éxerce un corps
sur celui-ci.
Or le CO2 piégé dans le col de la bouteille est proportionnelle au co2 dans le vin.Ainsi il s'établit un équilibre entre le CO2 dans le goulot et celui alors dissous dans le vin.La pression du CO2 dans le goulot encore dite
pression de vapeur saturante joue un rôle indispensable dans l'équilibre de toutes nos bonnes bouteilles de champagne... elle assure alors l'abscence de bulles dans la bouteille fermée car il est pour elles impossible
de s'échapper dans ces conditions.
Il est maintenant temps d'ouvrir la bouteille! Que se passe-t-il?
L'effervescence à l'ouverture d'une bouteille de champagne
Nous avons donc vu qu'il s'établit un équilibre dans chaque bouteille de champagne fermée entre le CO2 dissous dans le vin et celui dans le goulot. A l'ouverture de la bouteille cet équilibre est rompu brutalement.La solubilité du CO2 dans le champagne chute aussi brutalement , ainsi celui ci doit s'échapper (cf.I ) car une grande partie doit absolument retourner à l'état gazeux. Du fait qu'un nouvel équilibre doit s'instaurer on a vu ci-dessus (page.2) que le dégagement « potentiel » est de environ 5 litres de gaz... Dès lors nous savons pourquoi un tel dégagement gazeux mais maintenant étudions ce mécanisme complexe de plus près! Nous verrons dans cette partie que le dégagement du CO2 en excès sous forme de bulles ne représente que 15 à 20 % du dégazage! L'essentiel de ce dégagement de CO2 se produit à l'interfae air/liquide!Pouquoi pas que sous forme de bulles?
Le dégagement gazeux sous forme de bulles,mécanisme complexe « limité » par plusieurs barrières énergétiques:
Tout d'abord au sein du liquide ou même sur les parois les différentes molécules créent des liaisons,intéractions électriques entre elles qui représentent les forces de van der waals. Par conséquent la formation d'une bulle est limitée par une barrière énergétique qu'il faudra vaincre pour voir l'apparition et le décollement d'une bulle (et non d'une microbulle cf .ci-dessous). Ce qui précède la bulle est par toute logique la microbulle! On distinguera deux nucléations :-nucléation homogène et la nucléation hétérogène. Nous verrons qu'une microbulle ne peut diffuser que quand son rayon critique est dépassé. D'oû le fait que le CO2 ne pourra s'échapper sous forme de bulles dès que ce paramètre sera respecté.
La nucléation homogène au sein du champagne:Ce type de nucléation se passe au sein même du liquide.La microbulle apparaît dans des zones de faibles densités dues à des fluctuations de densités aux alentours.Une microbulle apparaît. Or on a vu que la microbulle va croître et diffuser en son sein seulement quand son rayon aura dépassé le rayon critique.En effet quand la bulle a un rayon trop faible alors elle a une pression interne très élevée(inversement proportionnelle à son rayon) d'ou le fait que le CO2 ne peut rentrer dans la bulle.Cette différence de pression s'explique en vertu de la Loi de Laplace qui dit que la pression intérieure d'une bulle de savon est égale à la pression à l'extérieur + 4 fois la tension superficielle divisé par le rayon. Celle-ci trop petite et ne grossissant pas,se résorbe et disparaît. Remarque:pour vaincre cette barrière énergétique il faudrait des concentrations en dioxyde de carbone dissous très supérieures. On a donc vu dans le cadre de la nucléation homogène que ce sont les caractéristiques physiques du champagne connues de nos jours qui empêchent l'apparition de la bulle.Par conséquent les bulles n'apparaissent pas spontanément dans le champagne! Alors la cause du pétillement provient de la présence d'impuretés sur les parois du verre (qui peuvent de détacher en présence de liquide).Dans une flute parfaitement lisse et propre le champagne ne mousserait pas. Remarque: ce n'est pas la forme du verre qui détermine l'apparition de bulles!
La nucléation hétérogène, sortie de secours du co2:Etudions de plus près cette nucléation qui est la seule à permettre l'apparition de bulles dans le champagne.
Par toute logique on peut se dire qu'il faudrait que la microbulle ait un rayon supérieur au rayon critique(cf.ci-dessus).Dans le cas de cette nucléation nous observons que les minuscules poches de
gaz (microbulles) piégées sur les parois ont leurs rayons nettement supérieurs au rayon critique par conséquent selon la formule (cf. ci-dessus) on comprend qu'elles diffuseront ainsi le CO2 en leur sein et grandiront.
La microbulle se fixe sur une impureté grâce à la tension superficielle
, en effet celle-ci agit sur la surface liquide-air(de la poche de gaz) et modifie la forme de celle-ci par conséquent on observe que la microbulle
réussit à s'attacher sur l'impureté.
La microbulle ayant un rayon supérieur au rayon critique , possède une pression interne plus faible que la pression du liquide qui l'entoure c'est ainsi que le CO2 encore en excès dans le champagne peut rentrer dans la
microbulle.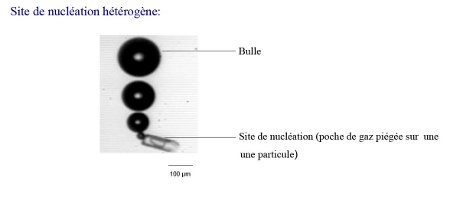
On peut donc comprendre que les microbulles apparaissent avec un rayon suffisant grâce à la présence d'impuretés ( comme des fibres de cellulose,calcaire...)
En effet ces poches de gaz sont piégées et peuvent grossir.
Nous pouvons donc en conclure que l'échappement du CO2 (dont la solubilité a fortement baissé) se fait sous deux formes principales:
- 80% à l'interface air/liquide
- et les « 20% » restants grâce aux bulles qui ont des pressions différentes et ainsi explique tout le phénomène de solubilité. Cest à ce moment qu'intervient le problème des forces de Van der Vaals , car la bulle s'est formée mais maintenant en raison des ces interactions... Nous analyserons ceci dans la partie suivante intitulée: L'ascension de la bulle!

